МУ 2.1.5.720-98, часть 3
Токсичность при внутрижелудочном введении определяется в опытах на животных (белых мышах массой 18—24 г, белых крысах массой 180—240 г, половозрелых морских свинках массой 350— 500 г, кроликах массой 1,5—3,0 кг).
8.2. Выбор доз для исследования осуществляется:
• по аналогии с данными о токсичности близких по структуре веществ;
• расчетным путем по математическим моделям;
• в ориентировочном эксперименте.
В ориентировочном эксперименте устанавливается зона смертельного действия - отношение абсолютной смертельной дозы к минимальной смертельной или максимальной переносимой. Затем выбирается ряд доз, например, в соответствии с рядами Фульда:
1,0; 1,3; 1,8; 2,4; 3,2; 4,2; 5,6; 7,5; 10,0; 13,0
1,0; 1,3; 1,7; 2,1; 2,8; 3,6; 4,6; 6,0; 7,7; 10,0; 13,0
1,0; 1,3; 1,6; 2,0; 2,5; 3,2; 4,0; 5,0; 6,3; 8,0; 10,0
Ориентировочная DL50 может быть установлена методом одной-двух точек или путем испытания ряда последовательных доз на 1—2 подопытных животных.
8.3. Количество животных в развернутом опыте должно быть достаточным для статистических расчетов. Каждая доза испытывается не менее, чем на 10 белых мышах, белых крысах, на 6 морских свинках, кроликах и других животных.
8.3.1. Вещество в каждой из выбранных доз (а для соединений 3 и 4 классов стабильности и ранее не нормированные продукты трансформации) вводится с помощью зонда однократно в водном растворе, при малой растворимости в воде - в растительном масле. Может быть применен «универсальный» растворитель - диметилсульфоксид. Труднорастворимые, вязкие, смоло-, порошкообразные вещества можно вводить в виде взвесей или эмульсии в яичном желтке, 1—2%-ном растворе крахмала, с добавлением нетоксичных поверхностно-активных веществ. В отдельных случаях допустимо использование других растворителей: этанола, глицерина, полипропиленгликоля и т.п. Обязательное условие - введение контрольным животным используемого растворителя в эквивалентных количествах.
8.3.2. Для создания необходимых доз предпочтительнее вводить разные объемы раствора вещества одной концентрации. Вместе с тем, объем водных растворов не должен превышать 1—1,5 %, а масляных - 0,5—1 % от веса тела. Вещество вводится через 2—3 часа после кормления. Через 3—4 часа после введения вещества допускается очередное кормление животных.
8.3.3. Максимальная вводимая доза в желудок - 10 г/кг. При испытании малотоксичных веществ, не приводящих к гибели при однократном введении, допустимо вводить вещество несколько раз в максимально возможной концентрации в объеме £ 5 %, а масляные растворы до 2 % от веса тела с интервалом между введениями не менее 1,5 часов. Следует учитывать и предотвращать возможное местное раздражающее действие веществ, испытывать нейтрализованные растворы при условии, что это не приведет к разрушению и трансформации структурной части молекулы, определяющей токсичность вещества.
8.4. Наблюдение за животными продолжается в течение 14 дней после введения вещества. Фиксируется время гибели каждого животного (в первые сутки - в часах), общее количество погибших. Результаты заносятся в таблицу (табл. 8.1). Подробно описывается клиническая картина отравления, желательно - морфологические изменения внутренних органов и тканей. Делаются предварительные выводы о характере токсического действия вещества.
Таблица 8.1
Динамика гибели животных после однократного введения
вещества в различных дозах
|
Дозы, мг/кг |
Число животных в |
Число погибших животных по срокам наблюдения в часах (сутках) |
Общее число погибших |
% гибели |
|||
|
|
группе |
|
|
|
|
животных |
|
|
|
|
|
|
|
|
|
|
8.5. Токсичность при накожном нанесении изучается согласно [1].
8.6. Расчет DL50 и доверительного интервала может проводиться любым из статистических методов, т. к. различия между величинами по результатам расчета значительно меньше, чем по экспериментальным данным, полученным в разных условиях. Более точным считается метод Литчфилда-Уилкоксона.
8.7. Для веществ из малоизученных классов необходимо определять сравнительную половую и видовую чувствительность на 4-х видах лабораторных животных, для остальных веществ - на 2-х видах. Определение острой токсичности на морских свинках, кроликах, кошках (в особых случаях) допустимо методом 1—2 точек. Метод дает возможность рассчитать ошибку и доверительные интервалы величин DL50 .
8.8. Для получения сопоставимых результатов целесообразно стандартизовать условия эксперимента по виду, полу, возрасту, условиям содержания животных. С другой стороны, не следует чрезмерно уточнять их путем увеличения числа животных, уменьшения шага между дозами, усложнения методов расчета.
8.9. При оценке результатов острых опытов могут использоваться классификации токсичности, представленные в таблице 8.2.
Кроме того, необходим анализ кривых «доза-ответ», которые могут соответствовать не только функции нормального распределения, но и гиперболе, параболе, экспоненциальной кривой. Угол наклона кривых к оси абсцисс может дать информацию об общности или, наоборот, резких различиях в механизме токсического действия ряда веществ или на различные виды животных.
Пологая кривая чаще всего свидетельствует о плохом всасывании, быстром выведении или трансформации, или о наличии резких различий в индивидуальной чувствительности. Выраженная крутизна наклона свидетельствует об активном всасывании, быстром развитии токсического эффекта, а также о незначительных различиях в индивидуальной чувствительности.
Таблица 8.2
Классификация токсичности по смертельным эффектам
|
Показатели токсикометрии, |
Классы токсичности |
|||
|
мг/кг |
1 |
2 |
3 |
4 |
|
1. DL50 в/ж |
<100 |
100—1000 |
1001—10000 |
>10000 |
|
2. DL50 при нанесении на кожу |
<100 |
100—500 |
501—2500 |
>2500 |
8.10. Дополнительно по данным острого опыта рассчитываются параметры, дающие первое представление о способности веществ к кумуляции: среднее время гибели (ТL50 ) и индекс кумуляции [1].
8.10.1. Для определения TL50 сопоставляется рабочая таблица, аналогичная таблице учета результатов острого опыта, сроки гибели животных выражаются в часах. По таблице подсчитывается суммарное время гибели животных от каждой из испытанных доз ( S t) , из которых находят среднее время гибели одного животного (tn ) по формуле: tn = S t/n, где n - общее количество животных, погибших от данной дозы. TL50 рассчитывают теми же статистическими методами, что и среднесмертельную дозу или строят прямоугольную систему координат (в логарифмическом масштабе), откладывая по оси абсцисс время гибели животных (в часах), а по оси ординат - изученные в опыте дозы вещества (в мг/кг). На график наносят точки, соответствующие ранее найденным значениям tn и через них проводят прямую, по которой находят TL50 - время гибели животных от дозы, равной DL50 .
Таблица 8.3
Классификация веществ по способности к кумуляции в острых опытах
|
Степень |
Показатели кумуляции |
Прогноз МНД по индексу |
|
|
кумуляции |
I |
TL50 , ч |
кумуляции |
|
1. Сверхкумуляция |
>0,5 |
>48 |
1/250000 DL50 |
|
2. Сильная |
0,1—0,5 |
>24—48 |
1/50000 DL50 |
|
3. Средняя |
<0,1 |
12—24 |
1/10000 DL50 |
|
4. Слабая |
0 |
<12 |
1/2000 DL50 |
По таблице 8.3 определяют, к какому классу по способности к кумуляции относится вещество. Если TL50 находится в пределах 12— 48 часов, допустимо применять расчетные уравнения для прогноза ПДхр. и МНД в соответствии с [4].
Для определения индекса кумуляции рассчитываются величины DL50 за 1 сутки (Д1 ) и по результатам гибели животных в течение всех 14 дней опыта (Д2 ). Затем определяют I :
I = 1 - Д 2 / Д 1
Классификация способности веществ к кумуляции и ориентировочные величины МНД приведены в таблице 8.3.
9. Порог вредного действия при однократном поступлении
вещества в организм
Цели исследований:
• определить верхний предел доз для подострого эксперимента и оптимальное время наблюдения после введения вещества;
• получить характеристику кумулятивных свойств;
• при необходимости - изучить токсикокинетику и процесс детоксикации вещества;
• рассчитать зону острого действия.
9.1. Порог однократного действия определяется на белых крысах по интегральным и специфическим показателям с обязательным определением изменений в динамике в течение суток (или нескольких суток - в зависимости от TL50 ). Время первого определения устанавливается, исходя из клинической картины отравления в остром опыте, но не позднее двух часов, затем, например, через 4—6—12—24 часа после затравки, а также через 2—4 и 8 дней после нее. Возможны и другие сроки наблюдения с учетом токсикодинамики и/или токсикокинетики. Порог однократного действия может быть установлен эмпирически или рассчитан как вероятностная величина (Limac ) или дополнен результатами токсикокинетических исследований.
9.2. Для специальных научных целей можно определить кинетику накопления и выведения вещества и/или его метаболитов в организме.
9.3. На основании исследования зависимости «время-эффект» можно определить время полуубыли ( t ) регистрируемого эффекта по формуле:
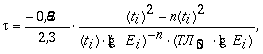 где
где
Ei - среднее значение степени эффекта (в % к параллельному контролю) в моменты времени ti (i - 1; 2;...; n);
0,693 - натуральный логарифм из 2;
2,3 - коэффициент перехода от натуральных логарифмов к десятичным.
Степень кумуляции определяют по величине t : при t < 12, 12—24, 24—48 и > 48 часов кумулятивные свойства оценивают как слабые, средние, сильные и очень выраженные соответственно.
9.4. Пример определения пороговой дозы однократного действия в опыте с ацетонциангидрином (АЦГ).
При выборе доз и сроков наблюдения исходили из результатов острого опыта:
ЛД50 = 18,5 (16,9 : 20,3) мг/кг, TL50 = 85 мин. Первые признаки отравления появлялись через 10—15 мин после введения ацетонциангидрина. Эти данные свидетельствуют о быстром развитии токсического процесса и слабо выраженной кумуляции.
Поэтому выбран минимальный интервал между дозами. Вещество вводилось однократно белым крысам в дозах, составляющих 1/5, 1/10, 1/15, 1/20 и 1/45 DL50 . Отбор исследуемого материала /кровь, печень/ производили через 15, 30 мин, 1, 2, 4 и 6 часов после введения АЦГ. Контролем служили интактные животные. Поскольку механизм токсического действия цианидов хорошо известен, исследовались только специфические показатели: содержание оксигемоглобина и роданидов в крови, активность цитохромоксидазы печени. Установлено, что максимальный токсический эффект (пик содержания оксигемоглобина и снижение активности цитохромоксидазы) для доз 1/5, 1/10, 1/15 DL50 наблюдается через 30 мин после введения вещества, а с уменьшением дозы (1/20, 1/45 DL50 ) срок достижения наибольших изменений увеличивается до 1 часа. Получены кривые зависимости «время-эффект» для разных доз.
По наиболее чувствительному показателю (изменению активности цитохромоксидазы) установлен порог однократного действия Limac , равный 1/45 DL50 (0,41 мг/кг). Зона острого действия DL 50 /Limac =45. Это доказывает, что способность АЦГ к кумуляции слабо выражена.
Исходя из полученных данных, для подострого эксперимента были выбраны дозы < Limac , т.е. 0,4; 0,08; 0,015 мг/кг с пятикратным шагом между ними.
10. Изучение действия вещества на организм в условиях подострого опыта
Подострые опыты могут проводиться с целью:
• выявления различными методами способности веществ к кумуляции;
• получения данных для обоснования класса опасности вещества, необходимости оценки хронической токсичности, выбора доз и тестов при планировании хронического опыта.
Подострый эксперимент является центральным звеном в гигиенических исследованиях, от его результатов зависит решение вопроса о необходимости и целесообразности дальнейших исследований вещества и их планирование. В условиях подострого опыта могут оцениваться и продукты трансформации веществ 3 и 4 классов стабильности в случае, если они не изучались ранее или химически не идентифицированы, а в острых экспериментах оказались токсичнее исходного соединения.
10.1. Наибольшую информативную ценность представляет подострый эксперимент, направленный на установление параметров токсикометрии в условиях, вызывающих не явные признаки нарушения жизнедеятельности организма, а изменения функциональных показателей, близкие к пороговым (в отличие от методов оценки кумуляции Ю. С. Кагана и В. В. Станкевича; Lim et al; Б.М. Штабского, использующих дозы, приводящие к смертельному эффекту).
Подострый эксперимент позволяет:
• изучить токсикодинамику в рамках зависимости «доза - эффект» во времени;
• определить характер (механизм) токсического действия; наиболее поражаемые функции, органы, системы организма;
• установить пороговую дозу подострого эксперимента (ПДпэк );
• выявить способность вещества к кумуляции;
• рассчитать зону кумулятивного действия;
• установить класс опасности по кумуляции;
• прогнозировать пороговую дозу хронического действия (ПДхр. ).
10.1.1. В эксперименте изучается не менее 3 доз вещества. Выбор доз осуществляется на основе прогноза ПДхр. и МНД с использованием математических моделей согласно п. 3.2.2., а также результатов определения Limac (раздел 9) [1,4].
Шаг между дозами определяется кумулятивностью вещества: 3—5-кратный - для 3—4 классов, 5—10-кратный - для 1—2 классов кумуляции.
10.1.2. Исследования проводятся, как правило, на белых крысах.
При выраженных (более 5 раз) различиях в видовой чувствительности обязательны дополнительные исследования на наиболее чувствительном виде животных. Вид подопытных животных определяется также особенностью биологических эффектов изучаемого вещества. Например, для изучения аллергенного эффекта используются морские свинки, для выявления мутагенного эффекта - специальные линии белых мышей, определения влияния на микрофлору кишечника - белые крысы и т. п.
10.1.3. Вещества вводятся в виде водного раствора внутрижелудочно (белые крысы) или перорально (кролики, морские свинки). Допустимо введение веществ в растительном масле или растворе крахмала. Если вещество хорошо растворяется в воде и не вызывает изменения ее органолептических свойств, предпочтительнее использовать автопоилки с ежедневным определением количества выпитого раствора. При понижении водопотребления по сравнению с контрольными животными, следует переходить на активное запаивание (внутрижелудочное введение). Введение веществ ежедневное, включая выходные дни.
10.1.4. Длительность опыта - не менее 30 дней. Однако опыт может быть продлен до 2—3 месяцев, если известно, что изучаемый препарат вызывает изменение замедленно реагирующих систем, например, липидного обмена, костной системы, обмена кальция и т. п.
10.1.5. Точность и надежность обоснования гигиенического норматива в основном определяется адекватностью функциональных показателей, выбранных для оценки состояния организма животных в подостром (а затем, в хроническом) эксперименте. Поскольку невозможно рекомендовать универсальный перечень таких показателей в силу специфичности действия отдельных веществ на организм, комплекс изучаемых показателей должен быть тщательно обоснован в каждом подостром эксперименте. Выбор показателей осуществляется с учетом всех имеющихся данных о механизме токсического действия вещества и его структурных аналогов [5, 6, 7, 8]. Желательно, чтобы выбранные показатели отражали состояние крови, печени, почек, центральной нервной системы, функции наиболее поражаемых органов.
После снятия фоновых значений показателей наблюдения проводятся на 5—10—20 и 30 сутки опыта. Если не определялся порог однократного действия, необходимо исследование в 1 сутки. Если продолжительность опыта превышает 30 дней, последующие снятия значений показателей функционального состояния организма животных проводятся каждые 2 недели.
10.1.6. В подостром опыте применяются дополнительные функциональные (физическая, термическая и т. п.) или материальные (амидопириновая, гексеналовая и т. п.) нагрузки; однократно в конце опыта или через каждые 2 недели. Нагрузка должна в наибольшей мере соответствовать механизму действия вещества.
Наиболее предпочтительна нагрузка изучаемым веществом в конце эксперимента в дозах, превышающих порог однократного действия в 2—5 раз в зависимости от способности к кумуляции.
10.2. В конце подострого опыта определяется ПДпэк - доза вещества, при энтеральном поступлении которой в организм в течение 30 дней возникают минимальные, но диагностически значимые изменения функциональных показателей состояния организма животных. При этом важна дифференциация закономерных и случайных проявлений токсического действия веществ.
10.2.1. Необходимо использовать следующие диагностические критерии ПДпэк :
• комплексный анализ зависимости «доза-эффект» во времени для не менее 3 доз веществ, различающихся в 3—10 раз;
• учет изменений небольшого числа или даже одного показателя, если он отражает особенности механизма токсического действия изучаемого или близких по структуре соединений;
• ориентация на минимальные сдвиги значений функциональных показателей, наблюдаемые неоднократно (не менее 2-х раз) в течение эксперимента;
• учет тенденции к изменениям, даже при отсутствии статистически достоверных различий с контролем, если они относятся к жизненно важным показателям;
• наличие экспериментально установленной недействующей дозы подострого опыта как дополнительного критерия пороговости.
10.2.2. Статистическими критериями пороговой дозы служат показатели достоверности отличий от контроля (t - критерий Стьюдента, отношения дисперсий по критерию F и др.). Необходимо проверять правомерность применения этих критериев, т. е. соответствие изучаемой выборки закону нормального распределения. В противном случае применяются другие методы статистической обработки, в т. ч. непараметрические.
При выборе количественного критерия значимости отклонений от нормы (контроля) (5%, 1%, 0,1%) учитывается биологическая значимость показателя, степень «пластичности», патогенетического соответствия. Кроме того, чем опаснее для жизнедеятельности организма выявленный эффект или чем важнее сфера применения вещества и шире контакт с населением, тем статистически менее значимые сдвиги значений показателя по сравнению с контролем следует принимать во внимание.
10.2.3. Для большей надежности при установлении ПДпэк , следует применять комплексный диагностический подход с оценкой адаптационных возможностей организма, в частности, по реакции на материальную или функциональную нагрузку. Дополнительно могут использоваться также изучение соотношения между показателями индивидуально у каждого животного, учет дискоординации сопряженных функций, определение безвредных доз на основе зависимости «доза-статус организма».
10.3. После установления ПДпэк определяется способность веществ к кумуляции по отношению DL50 /ПДпэк , класс опасности и коэффициент J для прогноза пороговой дозы хронического действия (табл. 10.2). Выбор коэффициента (J1 , J2 , J3 ) осуществляется в зависимости от степени изученности характера токсического действия вещества и структурного ряда, к которому оно принадлежит.
Таблица 10.2
Оценка опасности и прогноз пороговой дозы веществ
по результатам подострого опыта
|
Классы опасности |
Кумуляция по отношению DL50 /ПДпэк |
Коэффициент для расчета ПДхр. по ПДпэк |
||
|
|
|
J1 |
J2 |
J3 |
|
1. Чрезвычайно опасные |
³ 10000 |
20 |
100 |
не прим. |
|
2. Высокоопасные |
³ 100 0 |
5 |
10 |
100 |
|
3. Умеренно опасные |
³ 100 |
3 |
5 |
25 |
|
4. Малоопасные |
³ 10 |
2 |
3 |
10 |
11. Проведение хронического санитарно-токсикологического опыта
Хронический опыт проводится в случаях, указанных в главе 3, п. 3.2.5. Кроме того, хронический опыт проводят, если в подостром опыте выявлены новые виды эффектов, развитие которых соизмеримо с длительностью жизни, например, изменение костной системы, героэффект.
Цель хронического опыта - установить пороговую и максимальную недействующую дозы веществ при длительном воздействии на организм.
11.1. Основным ориентиром при выборе доз для хронического эксперимента является расчет ПДхр. по ПДпэк (табл. 10.2). Если же подострый эксперимент не был проведен, дозы и подопытные животные выбираются в соответствии п.п. 10.1.1, 10.1.2, 10.1.3.
11.2. Длительность опыта обычно составляет 3 месяца, но в случаях, указанных в п. 3.2.5, продлевается до 6—12 месяцев в зависимости от способности вещества к кумуляции, измененных показателей и задач исследований. Определение показателей в течение первого месяца - 2—3 раза, затем - ежемесячно.
11.3. Выбор показателей для оценки функционального состояния организма животных зависит от информации, полученной в подостром эксперименте:
• если в течение 30 дней удалось четко определить характер, механизм токсического действия веществ, то в хроническом опыте используется минимальное количество тестов, отражающих изменение наиболее чувствительных органов и систем;
• если характер токсического действия остался неясным, применяется широкий набор тестов, характеризующих функции различных органов и систем с тем, чтобы в ходе эксперимента выявить наиболее поражаемые из них.
В остальном выбор показателей для исследования проводится в соответствии с п.п. 3.2.5, 3.2.6 и 10.1.5.
Обязательным разделом является применение дополнительных нагрузок.
11.4. Изучение отдаленных эффектов и кожно-резорбтивного действия проводится согласно [1]. При наличии данных MAIR о принадлежности изучаемого вещества или веществ, близких по структуре, к канцерогенам, обоснование ПДК проводится с учетом этой особенности биологического действия.
По показаниям также определяется пороговая доза вещества по аллергенному эффекту.
11.5. Важным дополнительным разделом исследовании является изучение накопления веществ в органах, процессов метаболизма в начале и в конце интоксикации. Эти данные могут использоваться при обосновании «биологических нормативов», рекомендаций о тест-экспозициях для изучения влияния реального загрязнения окружающей среды на население, сравнительной оценки опасности вещества и продуктов трансформации и т. п.
11.6. На основании хронического эксперимента определяется пороговая доза (ПДхр. ). Критерии пороговой дозы те же, что в п. 10.3, дополнительный принцип - сопоставимость результатов подострого и хронического экспериментов.
11.7. Расчет МВД хронического опыта проводится исходя из величины ПДхр. с использованием коэффициентов запаса в зависимости от выраженности кумулятивных свойств и способности вещества вызывать отдаленные эффекты по таблице 11.1. Определяется также допустимая суточная доза при пероральном поступлении (ДСД). Если вещество является летучим, легко проникающим через кожу и достаточно широко распространено в окружающей среде, МНД устанавливается в процентах от допустимой суточной дозы в соответствии с существующими методиками и рекомендациями.
Таблица 11.1
Коэффициенты запаса (Кз ) для расчета МНД по величине ПД
|
Класс опасности |
К3 в зависимости от кумуляции |
Кз в зависимости от способности вызывать отдаленные эффекты |
|||
|
|
DL50 /ПД |
Кз от ПД общетоксич. действия |
Zsp |
Кз от ПД по влиянию на гонады |
Кз от ПД по влиянию на эмбриогенез |
|
I. Чрезвычайно опасные вещества |
³ 105 |
10 |
1 |
10 |
|
|
2. Высокоопасные вещества |
105 —103 |
5 |
0,1—1,0 |
5 |
10 |
|
3. Умеренно опасные вещества |
103 —102 |
3 |
0,01—0,1 |
3 |
|
|
4. Малоопасные вещества |
£ 102 |
3 |
0,01 |
3 |
|
12. Обоснование величины ПДК (ОДУ) веществ в воде
Для обоснования величины ПДК (ОДУ) исследуемого вещества в воде сопоставляются пороговые величины по органолептическому и общесанитарному признакам вредности и максимальная недействующая концентрация по токсикологическому признаку вредности (МНК).
12.1. МНК рассчитывается из величины МНД с учетом среднего веса человека и суточного водопотребления, включающего питьевую и используемую для приготовления пищи (чая, кофе) воду, по формуле:
![]() где
где
М - средняя масса взрослого человека;
V - объем суточного водопотребления;
К - обобщенный коэффициент пересчета МНК по МНД.
Средний вес взрослого человека равен 60 кг, а суточное водопотребление составляет 3 л. С учетом этих количественных соотношений, МНК рассчитывают по формуле:
МНК = МНД × 20
12.2. Величина МНК сопоставляется с пороговыми концентрациями по органолептическому и общесанитарным признакам вредности, и наименьшая из них принимается в качестве ПДК (ОДУ) с указанием соответствующего (органолептического, общесанитарного, санитарно-токсикологического) признака вредности.
12.3. Если вещество относится к 3 или 4 классу стабильности и выявлено образование продуктов трансформации в большей степени, чем исходное соединение, влияющих на качество воды, то:
• при неустановленной химической природе продуктов трансформации нормируется исходное вещество и вводится поправочный коэффициент, снижающий ПДК исходного вещества во столько раз, во сколько повышается опасность продуктов трансформации по сравнению с этим веществом;
• для химически идентифицированных продуктов трансформации должны быть обоснованы собственные гигиенические нормативы в соответствии с рекомендациями раздела 13.
12.4. Класс опасности устанавливается по таблице 3.1 с учетом корректив, вносимых согласно классу стабильности (табл. 5.1).
12.4.1. Для чрезвычайно стабильных веществ, способных к биоаккумуляции в трофических цепях, класс опасности по токсикогигиеническим показателям изменяется на единицу. Например, вещество 2-го класса опасности, но чрезвычайно стабильное (1-й класс стабильности) относят к 1-му классу опасности. При установлении величины К 3 вводится дополнительный коэффициент запаса, равный 10.
12.4.2. Если вещество отнесено к стабильным (2-й класс), класс опасности остается неизменным, но в величину ПДК вводится дополнительный коэффициент запаса К 3 = 5.
13. Нормирование препаратов смешанного состава
С позиций гигиены воды и санитарной охраны водоемов можно различать смеси веществ, поступающих в воду из различных источников (имеющих различное происхождение и в силу этого образующих смеси переменного состава); смеси, формирующиеся непосредственно в воде из исходно одиночных соединений в результате процессов трансформации (включая диссоциацию электролитов), а также технологические смеси заводского изготовления или природного происхождения, состав которых регламентируется техническими условиями (ТУ), ГОСТами, официальными формами лекарств и др. (смеси фиксированного или относительно постоянного количественного состава). Строго говоря, с тех же позиций к смесям веществ должны быть отнесены также все одиночные химические соединения, лекарства, содержащие примеси и/или добавки, технические препараты с одним действующим началом или реактивы, классифицируемые в химии по чистоте как «ч.», «ч. д. а», «х. ч», «ос. ч».
13.1. Гигиенически значимые характеристики многокомпонентных технологических смесей могут зависеть от наличия в составе таких компонентов, относительное содержание которых не превышает десятых долей процента. Поэтому технологические смеси подлежат изучению и регламентации в воде как самостоятельный объект гигиенического нормирования.
13.2. Согласно действующему санитарному законодательству, регламентация смесей веществ в воде водных объектов может быть проведена лишь при наличии ТУ и ГОСТов на их состав (фармакологических прописей). В этих документах, кроме того, должны быть приведены характеристики агрегатного состояния и стабильности смеси, ее растворимости в воде, другие известные физико-химические константы смеси и, по возможности, ее компонентов.
13.3. Технологические смеси постоянного (фиксированного) состава подлежат изучению как одно вещество, с установлением суммарных пороговых концентраций веществ, действующих в составе смеси, по влиянию на органолептические свойства воды и санитарный режим водоемов, а также суммарных максимальных неэффективных доз по общетоксическим и специфическим эффектам. На этой основе устанавливают, как обычно, лимитирующий признак вредности и класс опасности изучаемой смеси. Суммарная нормативная величина, найденная по лимитирующему признаку вредности, предназначена для использования при решении вопросов предупредительного санитарного надзора, для расчета ПДС и т. д., т. е. может использоваться в качестве ОДУ.
13.4. Для обоснования ПДК требуется решить вопрос о выборе соответствующих индикаторных веществ. Под индикаторным веществом понимается компонент смеси, по которому следует проводить аналитический контроль за реальным содержанием нормируемой смеси в воде в пределах суммарного норматива. Выбор индикаторного вещества проводится на основе критериев и принципов, приведенных ниже в порядке приоритетности:
• выявление наиболее токсичных и опасных компонентов и/или продуктов их трансформации;
• изучение сравнительной стабильности компонентов смеси в воде, в т. ч. по показателям биоразлагаемости;
• учет относительной массы (процентного содержания) веществ, входящих в состав смеси;
• учет компонентов, определяющих технологическое предназначение препарата;
